|
2021 : forte croissance du chiffre d’affaires et du BNPA des activités(1) permettant d’augmenter l’investissement en R&D
Paris, le 4 février 2022
T4 2021: Progression des ventes de 4,1% et du BNPA des activités(1) de 9,8% à TCC
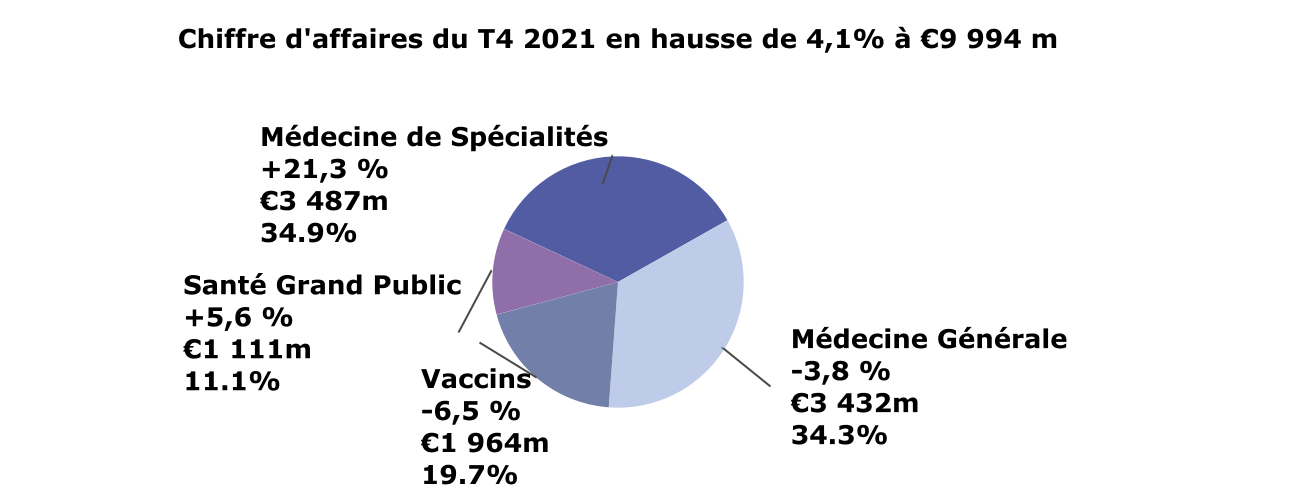
- La Médecine de Spécialités devient la première entité commerciale en termes de ventes (à €3 487 millions, +21,3%) portée par la performance de Dupixent® (+53,1%)
- Ventes des Vaccins à -6,5% malgré la forte performance en Europe, en raison de la diminution des vaccinations contre la grippe aux États-Unis et des livraisons records au T3
- Les produits stratégiques de la Médecine Générale sont en hausse de 2,1%; les ventes de la Médecine Générale (-3,8%) reflètent la priorisation et les cessions
- La Santé Grand Public poursuit sa dynamique de croissance (+5,6%) portée par les catégories Toux & rhume, Douleur et Santé digestive
2021: Progression des ventes de 7,1% et du BNPA des activités(1) de 15,5% à TCC
- Le chiffre d’affaires a progressé à €37 761 millions, soutenu par Dupixent® (+52,7% à €5 249 millions) et les Vaccins (+6,8% à €6 323 millions)
- Marge opérationnelle des activités en hausse de 1,3 ppt à 28,4%, reflétant l’amélioration de la marge brute et l’efficacité opérationnelle
- €2 410 millions d’économies ont été générées en 2020 et 2021, largement réinvestis dans les moteurs de croissance
- Le BNPA des activités est de €6,56, en hausse de 11,9% à données publiées et de 15,5% à TCC
- Le BNPA IFRS est de €4,97 (en baisse de 49,3%) reflétant la plus-value liée à la vente des actions Regeneron en 2020
- Le Free Cash Flow(2) atteint €8 096 millions, un doublement sur trois ans et un montant supérieur à l’objectif de 2022
- Le Conseil d’administration du 3 février a proposé un dividende de €3,33 soit une hausse de 4,1%
Avancées de la stratégie de Responsabilité Sociétale de l’Entreprise
- Sanofi Global Health et Medtronic vont collaborer pour élargir l’accès aux soins de santé dans les pays à revenu faible ou intermédiaire
- Avancées significatives des priorités RSE sur l’ensemble des 4 piliers Play to Win notamment la création de la Sanofi Global Health et le lancement de 2 pré-études cliniques sur des traitements contre les cancers pédiatriques
Transformation de la R&D et avancées réglementaires
- Homologation de Dupixent® dans l’asthme modéré à sévère chez les enfants âgés de 6 à 11 ans aux États-Unis
- Résultats positifs d’essais pivots concernant Dupixent® dans le prurigo nodulaire et l’œsophagite à éosinophiles
- Candidat vaccin de rappel à protéine recombinante contre la COVID-19 ayant démontré des réponses immunitaires élevées et homogènes, quel qu’ait été le vaccin initialement reçu
- Renforcement significatif du pipeline de phase précoce avec l’entrée en phase 1 de 7 projets et en phase 2 de 7 autres
- Accord d’acquisition d’Amunix en immuno-oncologie; portefeuille R&D d’agents biologiques à activation conditionnelle
- Acquisition d’Origimm, entreprise de biotechnologie spécialisée dans la recherche relative aux affections cutanées
Perspectives 2022
- Sanofi anticipe un BNPA des activités(1) 2022 en croissance “low double-digit(3)“ (dans le bas de la fourchette à deux chiffres(3)) à TCC, sauf événements majeurs défavorables imprévus. L’effet des changes sur le BNPA des activités 2022 est estimé à environ +2% à +3% en appliquant les taux de change moyens de janvier 2022.
Paul Hudson, Directeur Général de Sanofi, déclare :
« 2021 s’achève sur une performance solide de Sanofi au quatrième trimestre, portée par une croissance à deux chiffres des ventes de Dupixent® qui atteignent un nouveau record chaque trimestre. La Médecine de Spécialités est devenue notre première entité en termes de ventes, marquant le franchissement d’une nouvelle étape majeure dans notre transformation. Dans le même temps, l’entité Vaccins, portée par une autre année record de ventes de vaccins contre la grippe, poursuit sa trajectoire de croissance, comme nous l’avons démontré récemment lors de notre journée investisseurs dédiée aux vaccins. En R&D, nous restons fidèles à notre engagement et poursuivons sans relâche l’expansion d’un pipeline innovant. Au quatrième trimestre, Sanofi a atteint une première dans son histoire récente avec l’entrée de sept molécules en phase 1 de développement et le passage de sept programmes en phase 2, signe de notre capacité à faire progresser le développement de médicaments potentiellement révolutionnaires. En 2021, nous avons encore consolidé nos capacités de R&D à travers une série d’acquisitions créatrices de valeur. Notre excellente performance financière confirme notre capacité à accroître notre rentabilité par l’amélioration de notre mix produits, par le contrôle de nos dépenses et par le réinvestissement de nos économies dans nos moteurs de croissance. Nous sommes en bonne position pour atteindre nos objectifs financiers 2022.”
|
T4 2021 |
Variation |
Variation à TCC |
2021 |
Variation |
Variation à TCC |
| Chiffre d’affaires net IFRS publié |
9 994 m€ |
+6,5% |
+4,1% |
37 761 m€ |
+4,8% |
+7,1% |
| Résultat net IFRS publié(4) |
1 131 m€ |
+6,0% |
— |
6 223 m€ |
-49,4% |
— |
| BNPA IFRS publié |
0,90 € |
+5,9% |
— |
4,97 € |
-49,3% |
— |
| Cash flow libre(2) |
2 541m€ |
+66,1% |
— |
8 096m€ |
+16,0% |
— |
| Résultat opérationnel des activités |
2 256 m€ |
+9,9% |
+6,9% |
10 714 m€ |
+9,8% |
+13,3% |
| Résultat net des activités(1) |
1 730 m€ |
+13,3% |
+10,2% |
8 213 m€ |
+11,8% |
+15,5% |
| BNPA des activités(1) |
1,38 € |
+13,1% |
+9,8% |
6,56 € |
+11,9% |
+15,5% |
Sauf indication contraire, l’évolution du CA est exprimée à taux de change constants (TCC) (voir la définition Annexe 9) (1) Le commentaire du compte de résultat net des activités, indicateur non-GAAP, permet de rendre compte de la performance économique de Sanofi (voir définition à l’Annexe 9). Le compte de résultats consolidés du T4 2021 figure en Annexe 3 et le passage du résultat net IFRS au résultat net des activités, en Annexe 4; (2) Le Cash-flow libre est un indicateur non-GAAP (voir définition à l’Annexe 9); (3) Le BNPA des activités de 2021 s’élève à €6,56; (4) Le résultat net IFRS de 2020 intégrait la plus-value de cession des actions Regeneron au T2 2020.
Chiffre d’affaires de Sanofi du quatrième trimestre et de 2021
—————————-
Sauf indication contraire, les taux d’évolution du chiffre d’affaires sont exprimés à TCC1.
—————————-
Au quatrième trimestre 2021, le chiffre d’affaires de Sanofi a atteint 9 994 millions d’euros, soit une hausse de 6,5% à données publiées. L’effet des variations de taux de change a été positif de 2,4 points de pourcentage principalement en raison du dollar. À TCC, le chiffre d’affaires de Sanofi a progressé de 4,1%.
En 2021, le chiffre d’affaires de Sanofi s’est élevé à 37 761 millions d’euros, en hausse de 4,8% à données publiées. Les variations de taux de change ont eu un impact négatif de 2,3 points de pourcentage. À TCC, le chiffre d’affaires de Sanofi a progressé de 7,1%.
Entités commerciales globales (Global Business Units, GBUs)
Chiffre d’affaires du T4 2021 par GBU (variation à TCC; en millions d’euros; en % du chiffre d’affaires total)
Chiffre d’affaires du T4 2021 par zone géographique (variation à TCC; en millions d’euros; en % du chiffre d’affaires total)
Résultat opérationnel des activités du quatrième trimestre 2021
Au quatrième trimestre, le résultat opérationnel des activités a progressé de 9,9%, à 2 256 millions d’euros. À TCC, le résultat opérationnel des activités a augmenté de 6,9%. Le ratio résultat opérationnel des activités sur chiffre d’affaires a augmenté de 0,7 point de pourcentage, à 22,6% (22,5% à TCC). En 2021, le résultat opérationnel des activités a augmenté de 9,8%, à 10 714 millions d’euros. À TCC, le résultat opérationnel des activités a progressé de 13,3%. Le ratio résultat opérationnel des activités sur chiffre d’affaires a augmenté de 1,3 point de pourcentage, à 28,4% (28,6% à TCC).
Activité pharmaceutique
Au quatrième trimestre 2021, le chiffre d’affaires de l’activité pharmaceutique a augmenté de 7,4%, à 6 919 millions d’euros, soutenu par une croissance de 21,3% de la Médecine de Spécialités portée par la solide performance de Dupixent®, alors que le chiffre d’affaires de la Médecine Générale enregistre une baisse de 3,8%. En 2021, le chiffre d’affaires de l’activité pharmaceutique a augmenté de 7,6% pour atteindre 26 970 millions d’euros, reflétant la forte performance de la Médecine de Spécialités et la croissance des produits stratégiques de la Médecine Générale.
Médecine de Spécialités
Dupixent®
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| Total Dupixent® |
1 549 |
+53,1% |
5 249 |
+52,7% |
Au quatrième trimestre, les ventes de Dupixent® (collaboration avec Regeneron) ont progressé de 53,1%, à 1 549 millions d’euros. Aux États-Unis, les ventes de Dupixent® ont atteint 1 170 millions d’euros (+45,8%), soutenues par le maintien d’une demande forte dans la dermatite atopique chez les adultes, adolescents et enfants de 6 à 11 ans et par la poursuite de l’adoption dans l’asthme et la polypose nasosinusienne (PNS). Les prescriptions totales de Dupixent® (TRx, Total Prescriptions) ont augmenté de 44% (comparativement au quatrième trimestre 2020) et les nouvelles prescriptions (NBRx, New-to-Brand Prescriptions) ont progressé de 32% sur la même période, malgré la baisse de la fréquentation des cabinets des médecins, qui reste légèrement inférieure au niveau pré-COVID. En Europe, les ventes de Dupixent® au quatrième trimestre ont augmenté de 60.9% pour atteindre 187 millions d’euros, soutenues par la poursuite de la croissance dans la dermatite atopique ainsi que par de nouveaux lancements dans des populations plus jeunes dans dermatite atopique, l’asthme et la PNS. Au Japon, les ventes (inclus dans la région reste du monde) ont totalisé 85 millions d’euros (+53,4%).
En 2021, les ventes de Dupixent® ont atteint 5 249 millions d’euros, en hausse de 52,7% dont 3,971 millions d’euros générés aux États-Unis (+ 46,2 %). Chacune des deux régions Europe et Reste du monde a généré environ 50 % des ventes hors États-Unis en 2021.
Neurologie & immunologie
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| Aubagio® |
478 |
-1,9% |
1 955 |
-1,8% |
| Lemtrada® |
19 |
-14,3% |
82 |
-24,8% |
| Kevzara® |
91 |
+48,3% |
287 |
+23,7% |
| Total Neurologie et Immunologie |
588 |
+3,1% |
2 324 |
-0,3% |
Au quatrième trimestre, le chiffre d’affaires de la franchise Neurologie et Immunologie a augmenté de 3,1% à 588 millions d’euros, reflétant la hausse des ventes de Kevzara®, qui ont compensé partiellement la baisse des ventes d’Aubagio®. En 2021, les ventes en Neurologie et Immunologie sont restées stables.
Les ventes d’Aubagio® ont baissé de 1,9% au quatrième trimestre, à 478 millions d’euros, en raison d’une diminution des ventes aux États-Unis traduisant une concurrence accrue, partiellement compensée par l’augmentation des ventes en Europe.
Au quatrième trimestre, les ventes de Kevzara® (collaboration avec Regeneron) ont augmenté de 48,3% à 91 millions d’euros, principalement portées par la demande accrue de bloqueurs des récepteurs de l’IL-6 et la pénurie temporaire de tocilizumab.
Maladies rares
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| Myozyme® / Lumizyme® |
254 |
+5,5% |
1 003 |
+7,7% |
| Nexviazyme® |
15 |
ns |
17 |
ns |
| Fabrazyme®c |
223 |
+9,0% |
844 |
+6,5% |
| Cerezyme® |
181 |
+13,1% |
683 |
+3,9% |
| Aldurazyme® |
63 |
+7,0% |
243 |
+7,3% |
| Cerdelga® |
67 |
+11,9% |
254 |
+11,1% |
| Autres Maladies Rares |
15 |
-34,8% |
82 |
-3,4% |
| Total Maladies Rares |
818 |
+9,5% |
3 126 |
+7,0% |
Au quatrième trimestre, les ventes de la franchise Maladies rares ont augmenté de 9,5% pour atteindre 818 millions d’euros, portées par la performance des franchises des traitements de la maladie de Pompe, Gaucher et Fabry. En 2021, le chiffre d’affaires de la franchise Maladies rares a progressé de 7,0%, reflétant l’augmentation du nombre de nouveaux patients dans l’ensemble des trois zones géographiques. En 2021, la franchise Pompe a atteint plus d’1 milliard d’euros de chiffre d’affaires.
Au quatrième trimestre, les ventes de la franchise Pompe (Myozyme/Lumizyme® + Nexviazyme®) ont augmenté de 11,9 % à 269 millions d’euros, reflétant l’augmentation des ventes de Myozyme®/Lumizyme® de 5,5 % à 254 millions d’euros et le lancement de Nexviazyme® aux États-Unis et au Japon (ventes de 15 millions d’euros au quatrième trimestre et de 17 millions d’euros en 2021).
Au quatrième trimestre, les ventes de la franchise Maladie de Gaucher (Cerezyme® + Cerdelga®) ont augmenté de 12,8% (à 248 millions d’euros). Sur la même période, les ventes de Cerezyme® ont progressé de 13,1% pour atteindre 181 millions d’euros, reflétant une forte croissance dans le Reste du Monde. En Europe et aux États-Unis, les ventes de Cerezyme® ont baissé de 1,6% et 2,3%. En parallèle, les ventes de Cerdelga® ont progressé globalement de 11,9% soutenue par le remplacement de Cerezyme® par Cerdelga® et par les nouveaux patients en Europe et aux États-Unis.
Au quatrième trimestre, les ventes de Fabrazyme® ont augmenté de 9,0%, à 223 millions d’euros, portées par une demande accrue en Europe et dans le Reste du Monde ainsi qu’une augmentation des stocks en Europe.
Oncologie
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| Jevtana® |
110 |
-16,8% |
455 |
-12,3% |
| Sarclisa® |
54 |
+112,0% |
176 |
+318,6% |
| Fasturtec® |
41 |
+2,6% |
152 |
+2,0% |
| Libtayo® |
35 |
+78,9% |
129 |
+91,0% |
| Total Oncologie |
240 |
+10,3% |
912 |
+16,9% |
Au quatrième trimestre et en 2021, le chiffre d’affaires de l’Oncologie a augmenté de respectivement 10,3% (à 240 millions d’euros) et 16,9%, soutenu par les lancements de Sarclisa® et Libtayo® qui ont plus que compensé l’impact de la concurrence des génériques de Jevtana® en Europe.
Au quatrième trimestre, les ventes de Jevtana® ont baissé de 16,8%, à 110 millions d’euros, à la suite du lancement de génériques fin mars 2021 sur certains marchés européens (en baisse de 66,0%). Aux États-Unis, où le brevet de composition de Jevtana® a expiré en septembre 2021, les ventes ont augmenté de 13,3 %. Toutefois, Sanofi a intenté des actions en contrefaçon de brevet devant le Tribunal américain du District de Delaware sur le fondement de la loi Hatch-Waxman, contre les fabricants de génériques ayant déposé une demande d’approbation en faisant valoir trois brevets relatifs à la méthode d’utilisation, deux d’entre eux (US 10 583 110 et US 10 716 777) expirant en octobre 2030, tandis que l’autre (US 8 927 592) expire en avril 2031 incluant 6 mois d’exclusivité pédiatrique. Sanofi est parvenu à un accord à l’amiable avec certains des fabricants de génériques et les actions intentées contre les autres sont actuellement en cours. Aucune date de procès n’a été programmée et les défendeurs restants ont accepté de ne lancer aucun produit générique à base de cabazitaxel jusqu’à la première des deux dates suivantes : soit une décision du tribunal de district en faveur des défendeurs, ou quatre mois après le dépôt des mémoires à l’issue du procès. Par ailleurs, Jevtana® s’est vu accorder l’exclusivité des données sur les résultats de l’étude clinique CARD, qui expire en décembre 2023.
Au quatrième trimestre, les ventes de Sarclisa® se sont élevées à 54 millions d’euros (contre 25 millions d’euros au quatrième trimestre 2020) sous l’effet de lancements dans de nouveaux pays d’Europe (20 millions d’euros), d’une croissance aux États-Unis (21 millions d’euros) et dans le Reste du Monde (13 millions d’euros) portée par la performance au Japon.
Les ventes de Libtayo® (collaboration avec Regeneron) se sont élevées à 35 millions d’euros (+78,9%) au quatrième trimestre, soutenues par une demande accrue dans le carcinome épidermoïde cutané (CEC) et par des lancements dans de nouveaux pays. Aux États-Unis, les ventes de Libtayo® sont consolidées par Regeneron.
Maladies hématologiques rares
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| Eloctate® |
141 |
-12,2% |
563 |
-8,5% |
| Alprolix® |
113 |
-16,0% |
414 |
-7,9% |
| Cablivi® |
38 |
+23,3% |
164 |
+47,8% |
| Total Maladies hématologiques rares |
292 |
-10,4% |
1 141 |
-3,0% |
Au quatrième trimestre, les ventes de la franchise Maladies hématologiques rares ont baissé de 10,4%, à 292 millions d’euros. En excluant les ventes industrielles à Sobi, les ventes du quatrième trimestre ont augmenté de 2,7% reflétant la croissance de Cablivi® et d’Alprolix®. Les ventes industrielles d’Alprolix® et Eloctate® à Sobi en 2021 ont été significativement inférieures à celles de 2020 en raison d’une modification du contrat d’approvisionnement, ce qui a entraîné des ventes industrielles inhabituellement élevées à Sobi en 2020. En 2021, le chiffre d’affaires de la franchise Maladies hématologiques rares a baissé de 3,0 % et a enregistré une hausse de 8,0% si l’on exclut les ventes industrielles à Sobi.
Au quatrième trimestre, les ventes d’Eloctate® ont atteint 141 millions d’euros, soit une baisse de 12,2%. Si l’on exclut les ventes industrielles à Sobi, les ventes d’Eloctate® ont baissé de 4,4%, en raison du recul des ventes aux États-Unis (-3,9%), principalement lié à une variation des stocks. Dans le Reste du Monde, les ventes ont reculé de 28,3%, reflétant la baisse des ventes industrielles à Sobi (qui sont enregistrées dans cette région).
Au quatrième trimestre, les ventes d’Alprolix® ont enregistré une baisse de 16,0%, à 113 millions d’euros. Si l’on exclut les ventes industrielles à Sobi, les ventes d’Alprolix® ont progressé de 6,3%, soutenues par une croissance aux États-Unis (5,1%). Dans le Reste du Monde, les ventes ont reculé de 48,1%, reflétant la baisse des ventes industrielles à Sobi (qui sont enregistrées dans cette région).
Au quatrième trimestre, les ventes de Cablivi® se sont élevées à 38 millions d’euros (+23,3%), portées par des lancements en Europe (+50,0% à 19 millions d’euros). Aux États-Unis, les ventes sont restées stables à 19 millions d’euros, reflétant l’impact de la pandémie de COVID-19 sur l’initiation du traitement par Cablivi® en milieu hospitalier.
Médecine Générale
Au quatrième trimestre, le chiffre d’affaires de la Médecine Générale a baissé de 3,8%, à 3 432 millions d’euros et de 2,3% hors impact de la simplification du portefeuille et ventes de Praluent® aux Etats-Unis en 2020. La croissance des produits stratégiques2 de 2,1% (et de +3,9% hors ventes de Praluent® aux États-Unis) à 1 429 millions d’euros, a été soutenue par Multaq®, Plavix® et RezurockTM (consolidé depuis le 9 novembre). Les ventes des produits non stratégiques (1 783 millions d’euros) ont diminué de 7,6% reflétant la baisse des ventes des génériques ainsi que l’impact de la simplification du portefeuille (impact de -1,4 point de pourcentage).
En 2021, le chiffre d’affaires de la Médecine Générale a baissé de 1,4%, à 14 218 millions d’euros et a augmenté de 0,4% hors impact de la simplification du portefeuille et ventes de Praluent® aux Etats-Unis en 2020. Les ventes de produits stratégiques se sont élevées à 5 768 millions d’euros, soit une hausse de 5,6% (et de +7,6% hors ventes de Praluent® aux États-Unis) soutenue par la croissance à deux chiffres de Lovenox®, Mozobil® et Thymoglobuline® ainsi que par la performance de Toujeo®. Les ventes des produits non stratégiques se sont élevées à 7 642 millions d’euros, soit une baisse de 6,2% reflétant la simplification du portefeuille (impact de -1,8 point de pourcentage) et la diminution des ventes de Lantus®, d’Aprovel®/Avapro®.et des génériques.
Diabète
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| Lantus® |
583 |
-2,9% |
2 494 |
-3,8% |
| Toujeo® |
230 |
+1,8% |
969 |
+6,4% |
| Total insulines glargine |
813 |
-1,6% |
3 463 |
-1,2% |
| Soliqua® |
54 |
+13,0% |
195 |
+24,2% |
| Autres diabète |
224 |
-3,9% |
877 |
-3,7% |
| Total Diabète |
1 091 |
-1,5% |
4 535 |
-0,8% |
Au quatrième trimestre, le chiffre d’affaires global du Diabète a baissé de 1,5%, à 1 091 millions d’euros, reflétant une baisse des ventes en Europe (-4,0%) et dans le Reste du Monde (-8,8%) partiellement compensée par la hausse des ventes aux États-Unis (+10,4%). En 2021, le chiffre d’affaires du Diabète a baissé de 0,8%, principalement en raison d’une baisse des ventes de Lantus®, partiellement compensée par la croissance de Toujeo® et Soliqua®.
Au quatrième trimestre, les ventes de Toujeo® ont augmenté de 1,8%, à 230 millions d’euros, reflétant une croissance aux États-Unis et en Europe partiellement compensée par une baisse des ventes dans le Reste du Monde, reflétant un ajustement des prix et des stocks en Chine en anticipation de l’implantation du programme Volume Based Procurement (VBP) pour les insulines au premier semestre de 2022.
Sanofi a participé à l’appel d’offres du programme VBP pour les analogues de l’insuline basale en Chine en novembre dernier et a été parmi les lauréats du groupe A avec Lantus®/Toujeo®. Ainsi, Sanofi va conserver à l’hôpital un niveau de volume significatif de ses insulines à longue durée d’action. En conséquence, Sanofi s’attend à ce que ses ventes d’insulines glargine (Toujeo®/Lantus®) diminuent d’environ 30% en 2022 en Chine reflétant des volumes élevés à des prix nettement inférieurs. Les ventes de Toujeo®/Lantus® se sont élevées à 459 millions d’euros en Chine en 2021.
Les ventes de Lantus® se sont établies à 583 millions d’euros, en baisse de 2,9% au quatrième trimestre, reflétant la baisse en Europe et en Chine partiellement compensée par la croissance aux États-Unis. En Chine, la baisse des ventes est liée à un ajustement des prix et des stocks en anticipation du programme VBP pour les insulines.
Au quatrième trimestre, les ventes de Soliqua® ont progressé de 13,0% pour atteindre 54 millions d’euros, portées par une croissance dans l’ensemble des trois zones géographiques. Les ventes de Soliqua® ont augmenté de 30,0% dans la zone Reste du Monde, principalement sous l’effet de nouveaux lancements.
Cardiovasculaire & Produits de prescription établis
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| Lovenox®* |
335 |
-7,9% |
1 486 |
+12,0% |
| Plavix®* |
222 |
+7,5% |
929 |
+2,4% |
| Aprovel®/Avapro® |
112 |
-6,1% |
419 |
-24,5% |
| Thymoglobuline® |
87 |
+5,0% |
350 |
+13,3% |
| Multaq® |
99 |
+20,3% |
329 |
+8,3% |
| Praluent® |
55 |
-15,9% |
218 |
-15,8% |
| Mozobil® |
63 |
+3,4% |
233 |
+10,7% |
| Génériques |
133 |
-30,9% |
699 |
-7,7% |
| Autres |
1 015 |
-2,9% |
4 212 |
-4,5% |
| Total Cardiovasculaire & Produits de prescription établis |
2 121 |
-4,5% |
8 875 |
-1,8% |
*Hors ventes d’auto-génériques
Au quatrième trimestre, le chiffre d’affaires de la franchise Cardiovasculaire et Produits de prescription établis a diminué de 4,5%, à 2 121 millions d’euros. La performance des produits stratégiques tels que Plavix®, Multaq®, Praluent® et la consolidation de RezurockTM ont été plus que compensées par la baisse des ventes de Lovenox® et des génériques ainsi que par l’impact des cessions de produits non stratégiques. En 2021, le chiffre d’affaires de la franchise Cardiovasculaire et Produits de prescription établis a reculé de 1,8% (en baisse de 0,7% hors Praluent® aux États-Unis), essentiellement en raison de la baisse des ventes d’Aprovel®/Avapro® et des génériques ainsi que des cessions, qui ont compensé la forte croissance de plusieurs produits stratégiques.
Au quatrième trimestre, les ventes de Lovenox® ont atteint 335 millions d’euros, soit une baisse de 7,9%, reflétant une base de comparaison 2020 élevée (soutenue par les recommandations de l’OMS concernant l’utilisation d’héparines de bas poids moléculaire chez les patients atteints de COVID-19 hospitalisés), une limitation de l’approvisionnement, ainsi que la concurrence des biosimilaires en Europe (-11,1%).
Les ventes de Plavix® ont augmenté de 7,5% à 222 millions d’euros, reflétant principalement une croissance dans le Reste du Monde (+11,4%) portée par la Chine (+28,1% à 88 millions d’euros) qui a largement compensé la baisse des ventes au Japon et en Europe.
Au quatrième trimestre, les ventes d’Aprovel®/Avapro® ont baissé de 6,1%, à 112 millions d’euros.
Au quatrième trimestre, les ventes de Praluent® ont baissé de 15,9%, à 55 millions d’euros, reflétant la restructuration de l’accord avec Regeneron qui a pris effet le 1er avril 2020. Sanofi a ainsi l’entière responsabilité de Praluent® en dehors des États-Unis et Regeneron l’entière responsabilité de Praluent® aux États-Unis. En excluant les ventes aux États-Unis, le chiffre d’affaires de Praluent® a augmenté de 35,9% porté par la solide performance en Europe. Depuis le début de 2022, Praluent® figure sur la liste nationale des médicaments remboursés (NRDL, National Reimbursement Drug List) en Chine.
Au quatrième trimestre, les ventes de Multaq® sont progressé de 20,3% à 99 millions d’euros soutenues par la forte croissance aux États-Unis.
Les ventes de RezurockTM, premier et seul traitement approuvé par la FDA en juillet 2021 pour le traitement de la maladie chronique du greffon contre l’hôte de l’adulte et de l’enfant à partir de 12 ans, après l’échec d’au moins deux lignes de traitement systémique antérieures, ont été consolidées à partir du 9 novembre (acquisition de Kadmon) et ont représenté 20 millions d’euros depuis cette date.
Résultat opérationnel des activités pharmaceutiques
Au quatrième trimestre, le résultat opérationnel des activités pharmaceutiques a augmenté de 16,4%, à 2 091 millions d’euros (+12,5% à TCC). Le ratio du résultat opérationnel des activités sur chiffre d’affaires a augmenté de 1,7 point de pourcentage, à 30,2% (29,9% à TCC) reflétant une amélioration de la marge brute. En 2021, le résultat opérationnel des activités pharmaceutiques a augmenté de 2,2%, à 9 409 millions d’euros (+4,9% à TCC). Le ratio résultat opérationnel des activités sur chiffre d’affaires a baissé de 1,0 point de pourcentage, à 34,9% (35,0 à TCC), reflétant les investissements relatifs à Dupixent® partiellement compensés par une amélioration de la marge brute.
Vaccins
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| Vaccins Polio/Coqueluche/Hib (PPH)
(Hexaxim® / Hexyon®, Pentacel®, Pentaxim® et Imovax® inclus) |
543 |
+7,7% |
2 159 |
+4,2% |
| Vaccins grippe
(Fluzone® HD/Efluelda®, Fluzone®, Flublok®, Vaxigrip®inclus) |
1 093 |
-12,4% |
2 628 |
+5,9% |
| Vaccins Méningite
(y compris Menactra® et MenQuadfi®) |
91 |
-31,2% |
658 |
+21,1% |
| Vaccins Rappels (Adacel® inclus) |
124 |
-1,6% |
488 |
+6,0% |
| Vaccins pour voyageurs et vaccins endémiques |
91 |
+17,1% |
306 |
+3,3% |
| Autres vaccins |
22 |
+57,1% |
84 |
+26,5% |
| Total Vaccins |
1 964 |
-6,5% |
6 323 |
+6,8% |
Au quatrième trimestre, le chiffre d’affaires des Vaccins a diminué de 6,5%, à 1 964 millions d’euros, reflétant la baisse des vaccins contre la grippe aux États-Unis, partiellement compensée par le succès de l’expansion d’Efluelda® en Europe ainsi que la performance des vaccins Polio/Coqueluche/Hib (PPH) dans le Reste du Monde. En 2021, les ventes de Vaccins ont augmenté de 6,8%, portées par les vaccins contre la grippe, la méningite et la franchise PPH .
Au quatrième trimestre, les ventes des vaccins Polio/Coqueluche/Hib (PPH) ont atteint 543 millions d’euros, en hausse de 7,7% portées par Pentaxim® en Chine et Hexaxim® en Europe. Aux États-Unis, les ventes de Pentacel® ont baissé en raison d’une variation des stocks et de la monté en puissance progressive de Vaxelis®. Vaxelis® a été lancé aux États-Unis en juin 2021 et ses ventes sur le marché aux États-Unis ne sont pas consolidées (les profits sont répartis à part égale entre Merck et Sanofi).
Les ventes de vaccins contre la grippe ont baissé de 12,4% au quatrième trimestre pour atteindre 1 093 millions d’euros. Les ventes de vaccins contre la grippe aux États-Unis ont baissé de 48,3%, en raison de la baisse de la vaccination comparée à 2020 liée à la priorité donnée au rappel de la vaccination COVID-19 dans les pharmacies aux États-Unis ainsi que d’un approvisionnement plus précoce aux États-Unis au troisième trimestre. Aux États-Unis, Fluzone® HD a gagné 3,5 points de part de marché malgré une contraction du marché de 17 % en volume (Sources: IQVIA Claims Medical (au 01/01/22); IQVIA Claims Retail (au 02/01/22)). En Europe, les ventes de vaccins contre la grippe ont augmenté de 51,1% soutenues par le marché allemand où une recommandation pour Efluelda® comme vaccin préféré chez les plus de 60 ans a été adoptée. Dans le Reste du Monde, les ventes de vaccins contre la grippe ont augmenté de 22,7%. 2021 a été une nouvelle année record pour les vaccins grippe avec des ventes en progression de 5,9% à 2 628 millions d’euros.
Au quatrième trimestre, les ventes des vaccins Méningite ont atteint 91 millions d’euros, soit une baisse de 31,2% reflétant une base de comparaison élevée au quatrième trimestre 2020 en raison d’un rattrapage des vaccinations.
Au quatrième trimestre, les ventes de vaccins Rappel ont diminué de 1,6%, à 124 millions d’euros, en raison de la baisse des ventes dans le Reste du Monde partiellement compensée par la croissance en Europe. Le taux de vaccination des vaccins Rappel n’a pas encore atteint son niveau d’avant COVID.
Au quatrième trimestre, les ventes de Vaccins pour voyageurs et vaccins endémiques ont augmenté de 17,1% par rapport à un faible niveau en 2020 en raison de la pandémie de COVID-19.
Résultat opérationnel des activités liées aux Vaccins
Au quatrième trimestre, le résultat opérationnel des activités Vaccins a diminué de 22,3% (-23,9% à TCC), à 653 millions d’euros, reflétant la baisse des vaccins contre la grippe aux États-Unis et l’accélération des dépenses de R&D avec la consolidation de Translate Bio et le Centre d’excellence sur les vaccins à ARNm. Le résultat opérationnel des activités rapporté au chiffre d’affaires a été de 33,2% (contre 40,8% au quatrième trimestre 2020). En 2021, le résultat opérationnel des activités Vaccins a augmenté de 11,7% (+12,5% à TCC) à 2 609 millions d’euros, reflétant la performance des ventes, des gains d’efficacité ainsi que le paiement de Daiichi Sankyo au premier trimestre 2021. Le ratio résultat opérationnel des activités sur chiffre d’affaires a augmenté de 2,2 points de pourcentage, à 41,3% (41,2% à TCC). Hors paiement de Daiichi Sankyo, le ratio résultat opérationnel des activités sur chiffre d’affaires a atteint 39,4% en 2021.
Santé Grand Public
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| Allergie |
127 |
+6,1% |
612 |
+2,9% |
| Toux & rhume |
116 |
+43,8% |
320 |
-15,2% |
| Douleur |
275 |
+7,1% |
1 093 |
+7,2% |
| Santé digestive |
276 |
+5,5% |
1 131 |
+17,6% |
| Bien-être physique |
79 |
-3,8% |
323 |
-5,2% |
| Bien-être mental |
51 |
0,0% |
211 |
+12,5% |
| Hygiène personnelle |
132 |
+5,8% |
519 |
+3,5% |
| Autres |
55 |
-26,7% |
259 |
-11,0% |
| Total Santé Grand Public |
1 111 |
+5,6% |
4 468 |
+4,6% |
Au quatrième trimestre, les ventes de la Santé Grand Public ont augmenté de 5,6%, à 1 111 millions d’euros, portées par une croissance aux États-Unis et en Europe. Cette croissance reflète la performance des catégories Toux et rhume et Douleur, celle-ci ayant bénéficié de la vaccination contre la COVID-19. En 2021, les ventes de la Santé Grand Public ont augmenté de 4,6%, principalement en raison de l’augmentation des ventes des catégories Santé digestive, Douleur et Bien-être mental, qui ont plus que compensé la faible prévalence de toux et de rhume de l’hiver dernier et les cessions de produits non-stratégiques (impact de -0,8 point de pourcentage).
Aux États-Unis, les ventes de la Santé Grand Public ont augmenté de 12,6%, à 280 millions d’euros, reflétant une croissance à deux chiffres des catégories Allergie, Douleur, Hygiène personnelle et Santé digestive.
En Europe, les ventes de la Santé Grand Public au quatrième trimestre ont augmenté de 7,5%, à 345 millions d’euros, reflétant principalement une croissance des catégories toux et rhume ainsi que la catégorie Douleur, qui a bénéficié de la vaccination contre la COVID-19.
Dans le Reste du Monde, le chiffre d’affaires de la Santé Grand Public au quatrième trimestre a augmenté de 0,8%, à 486 millions d’euros, reflétant une forte croissance des catégories Toux et rhume et Santé digestive partiellement compensée par la baisse des ventes des catégories Allergie, Douleur et Bien-être physique.
Résultat opérationnel des activités Santé Grand Public
Au quatrième trimestre, le résultat opérationnel des activités Santé Grand Public a baissé de 2,0% (-5,3% à TCC), à 298 millions d’euros. Le ratio résultat opérationnel des activités sur chiffre d’affaires a baissé de 2,7 points de pourcentage à 26,8%, par rapport au quatrième trimestre 2020 qui intégrait une plus-value liée à la cession de produits non-stratégiques. En 2021, le résultat opérationnel des activités Santé Grand Public a augmenté de 5,9% (+10,2% à TCC), à 1 493 millions d’euros porté par la progression des ventes, un strict contrôle des dépenses opérationnelles ainsi que par l’augmentation des plus-values liées à la cession de produits non-stratégiques Le ratio du résultat opérationnel des activités sur chiffre d’affaires a progressé de 1,3 point de pourcentage, à 33,4% (33,8% à TCC).
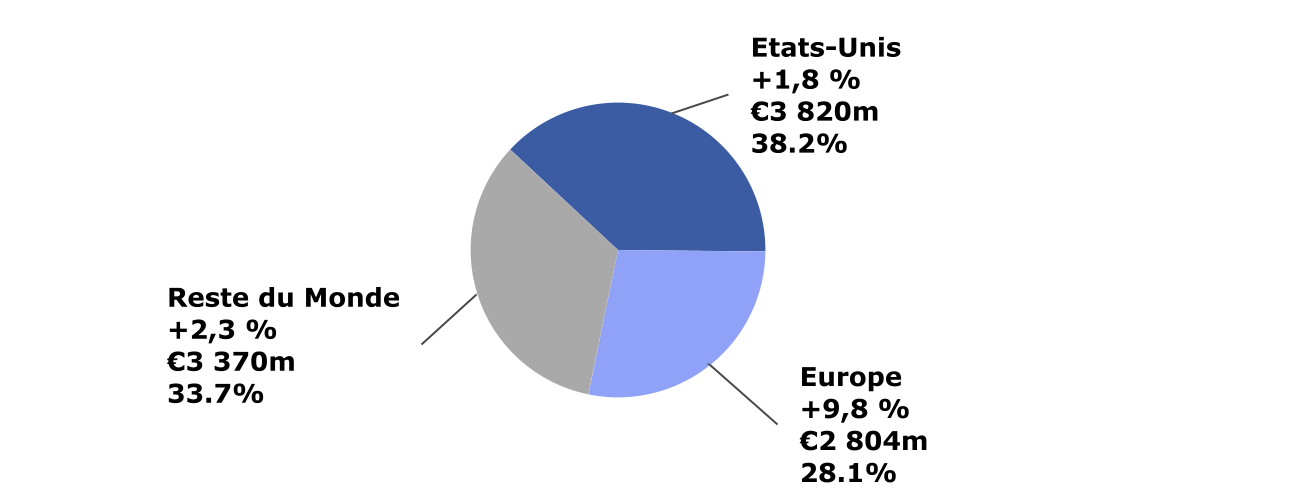
Chiffre d’affaires de Sanofi par zone géographique
| Chiffre d’affaires (en M€) |
T4 2021 |
Variation
à TCC |
2021 |
Variation
à TCC |
| États-Unis |
3 820 |
+1,8% |
14 385 |
+10,3% |
| Europe |
2 804 |
+9,8% |
9 759 |
+6,6% |
| Reste du Monde |
3 370 |
+2,3% |
13 617 |
+4,4% |
| dont Chine |
558 |
+5,7% |
2 720 |
+7,9% |
| dont Japon |
404 |
+0,5% |
1 657 |
+1,7% |
| dont Brésil |
164 |
-21,3% |
815 |
+7,3% |
| dont Russie |
136 |
-8,8% |
575 |
-4,8% |
| Chiffre d’affaires total |
9 994 |
+4,1% |
37 761 |
+7,1% |
Au quatrième trimestre, les ventes aux États-Unis ont augmenté de 1,8%, à 3 820 millions d’euros, soutenues par la forte performance de Dupixent® et une croissance à deux chiffres de la Santé Grand Public, du Diabète et de l’Oncologie. En 2021, les ventes aux États-Unis ont progressé de 10,3%, reflétant principalement la performance de Dupixent® et la croissance à deux chiffres de la Santé Grand Public.
En Europe, les ventes au quatrième trimestre ont augmenté de 9,8%, à 2 804 millions d’euros, essentiellement portées par la performance de Dupixent® et la forte croissance des Vaccins. En 2021, les ventes en Europe ont augmenté de 6,6% sous l’effet de la croissance de la Médecine de Spécialités, notamment Dupixent® et des Vaccins.
Dans le Reste du Monde, le chiffre d’affaires a progressé de 2,3%, à 3 370 millions d’euros, au quatrième trimestre, reflétant les performances de Dupixent® et des Vaccins, qui ont plus que compensé la baisse des ventes de la Médecine Générale. En Chine, les ventes ont augmenté de 5,7%, à 558 millions d’euros, portées principalement par Dupixent®, Plavix® et les Vaccins. Au Japon, les ventes au quatrième trimestre ont augmenté de 0,5%, à 404 millions d’euros, portées par les performances de Dupixent® et Sarclisa®, qui ont plus que compensé la baisse des ventes des Produits de prescription établis. Dans le Reste du Monde, les ventes 2021 ont augmenté de 4,4%, portées essentiellement par la croissance des produits de Médecine de Spécialités, notamment Dupixent®, ainsi que des Vaccins et de la Santé Grand Public.
Mise à jour R&D au terme du quatrième trimestre 2021
Mise à jour réglementaire
- La Food and Drug Administration (FDA) des États-Unis a approuvé Dupixent® en tant que traitement de fond additionnel de l’asthme modéré à sévère à phénotype éosinophilique ou dépendant des corticostéroïdes par voie orale chez les enfants de 6 à 11 ans.
- La FDA a accordé un examen prioritaire à la demande de licence de produit biologique (BLA, Biologics License Application) concernant olipudase alfa, comme enzymothérapie substitutive pour le traitement chronique des manifestations neurologiques hors système nerveux central, liées au déficit en sphingomyélinase acide (ASMD) chez l’adulte et l’enfant. La FDA devrait rendre sa décision le 3 Juillet 2022 (PDUFA). Habituellement connue sous le nom de maladie de Niemann-Pick de type A et de type B, l’ASMD est une maladie rare pouvant affecter les adultes et enfants. La prévalence de cette dernière est estimée à environ 2 000 personnes aux États-Unis, Europe (EU5) et Japon. En raison de la rareté de cette maladie, de nombreux patients restent sans diagnostic, ou tardent à recevoir le diagnostic adéquat, alors que les complications de la maladie progressent. Olipudase alfa a reçu plusieurs désignations spéciales d’agences réglementaires de Santé, reconnaissant ainsi son potentiel d’innovation thérapeutique. Des demandes d’autorisations pour olipudase alfa sont en cours d’évaluation au Japon et dans l’Union Européenne. Si ce dernier est autorisé, olipudase alfa sera le premier et unique traitement pour le déficit en sphingomyélinase acide.
- La FDA a accepté d’examiner une demande supplémentaire de licence de produit biologique (sBLA) pour Libtayo® en association avec une chimiothérapie, dans le traitement de première intention du cancer bronchopulmonaire non à petites cellules (CBNPC) de stade avancé. La FDA devrait rendre sa décision le 19 septembre 2022 (PDUFA).
- Le Comité des médicaments à usage humain (CHMP) de l’Agence européenne des médicaments (EMA) a réaffirmé son avis concernant l’avalglucosidase alpha en statuant qu’il ne peut être qualifié de nouvelle substance active (NAS). Sanofi a exprimé son désaccord concernant la conclusion du CHMP sur ce statut NAS et examine actuellement les possibilités envisageables pour l’avalglucosidase alfa dans l’Union européenne.
Mise à jour du portefeuille
Phase 3 :
- Un essai pivot d’évaluation de Dupixent® dans le traitement des adultes présentant un prurigo nodulaire non contrôlé a satisfait à son critère d’évaluation principal ainsi qu’à tous ses principaux critères secondaires ; mettant en évidence une diminution significative des démangeaisons et lésions cutanées comparé au placebo. Le prurigo nodulaire non contrôlé fait partie des maladies inflammatoires dermatologiques ayant un fort impact sur la qualité de vie en raison de démangeaisons intenses et chroniques.
- Les résultats d’un second essai de phase 3 portant sur l’utilisation expérimentale de Dupixent®, à raison de 300 mg par semaine, chez des patients âgés de 12 ans et plus, présentant une œsophagite à éosinophiles (EoE), ont satisfait aux co-critères d’évaluation principaux de l’essai qui étaient une amélioration significative des mesures cliniques et histologiques de la maladie comparés au placebo.
- Un essai mené par le groupe d’étude German-Speaking Myeloma Multicenter Group (GMMG) chez des patients présentant un myélome multiple (MM) nouvellement diagnostiqué et traité par Sarclisa® en association avec le lénalidomide, le bortézomib et la dexaméthasone (RVd), a satisfait à son critère principal, à savoir le taux de maladie résiduelle (MRD) négative après traitement d’induction et avant greffe. Il s’agit du premier essai de phase 3 présentant des résultats satisfaisant le critère principal de négativité de la maladie résiduelle chez des patients atteints d’un myélome multiple nouvellement diagnostiqué et éligibles à la greffe. L’étude en cours, après deuxième randomisation, a pour but d’évaluer la survie sans progression (SSP) de l’association thérapeutique Sarclisa® et lénalidomide en traitement de fond.
- Les données positives de deux études de Phase 3 (ATLAS-A/B et ATLAS-INH) d’évaluation de l’efficacité et de la sécurité de fitusiran, un petit ARN interférent (siRNA), dans le traitement prophylactique de l’hémophilie A ou B chez les adultes et adolescents, avec ou sans inhibiteurs, ont été présentées lors du congrès annuel de l’American Society of Hematology (ASH). A travers les résultats cumulés de ces deux études, le traitement prophylactique par fitusiran permettrait une réduction de plus de 89 % du taux de saignement annualisé en comparaison aux bras témoins, démontrant une amélioration statistiquement significative et cliniquement notable des hémorragies, comparé aux traitements à la demande, et à une amélioration importante de la qualité de vie. Le programme clinique de phase 3 est actuellement en train d’évaluer l’efficacité et la sécurité de fitusiran selon un protocole modifié, incluant de plus faibles doses et un schéma posologique étendu chez l’adulte et l’adolescent.
- Tolebrutinib, inhibiteur expérimental de la tyrosine kinase de Bruton (BTK) administré par voie orale et à pénétration cérébrale, a démontré une tolérance favorable à un an, après 48 semaines de traitement dans une étude de phase 2b d’extension à long terme, chez des patients présentant des formes cycliques de sclérose en plaques (SEP). Ces données ont été présentées au 37e congrès du Comité européen pour le traitement et la recherche concernant la sclérose en plaques (ECTRIMS).
- Un premier patient a été inclus dans un nouvel essai clinique pivot évaluant l’efficacité et la sécurité de tolebrutinib dans le traitement de la myasthénie grave (MG). Cette étude de phase 3 multicentrique, randomisée, et en double aveugle, vise à évaluer tolebrutinib comparé au placebo chez 154 patients âgés de 18 à 85 ans atteints de MG modérée à sévère. Le critère d’évaluation principal consiste en l’évolution du score des activités quotidiennes dans la MG (Myasthenia Gravis-Activities of Daily Living Profile), grâce à l’échelle d’auto-évaluation en huit points afin d’évaluer les symptômes de la MG et ses effets au quotidien.
- Les résultats préliminaires d’un essai clinique d’évaluation de la sécurité d’emploi et de l’immunogénicité d’une dose unique de rappel du candidat vaccin à protéine recombinante avec adjuvant contre la COVID-19, ont présenté des réponses immunitaires élevées et homogènes, quel que soit le vaccin initialement administré. L’essai de phase 3 continue d’accumuler les événements pour atteindre le nombre nécessaire à l’analyse ; les résultats sont attendus pour le premier trimestre 2022.
- Les données détaillées de l’étude de phase 2/3 MEDLEY et de l’étude de phase 3 MELODY ont été présentées au congrès ReSViNET 2021, mettant en avant le potentiel de nirsevimab en tant que traitement unidose préventif chez le nourrisson entrant dans la première saison du virus respiratoire syncytial (RSV).
Phase 2 :
- Un premier patient a été inclus dans une étude évaluant tusamitamab ravtansine, un anticorps conjugué (ADC) anti-CEACAM5, en association avec le ramucirumab chez des patients préalablement traités pour un cancer gastrique.
- Le recrutement des premiers patients de trois études cliniques de multi-cohortes, non randomisées, en ouvert, et multicentriques, évaluant SAR444245 (ou THOR707), une IL-2 non-alpha, a débuté. Dans ces études, SAR444245 est utilisé en association avec d’autres anticancéreux dans le traitement de patients atteints de CBNPC ou mésothéliome, ainsi que de carcinome épidermoïde de la tête et du cou, et avec ou sans autres anticancéreux dans le traitement de lymphome B en rechute ou réfractaire. Sanofi prévoit de recruter plus de 500 patients à travers ces trois essais.
- Un premier patient a été inclus dans l’étude évaluant SAR442720, un inhibiteur de SHP2 également appelé RMC-4630, en association avec le sotorasib, un inhibiteur de KRAS, dans le traitement en deuxième intention ou plus tard de patients présentant un CBNPC avec mutation KRASG12C. Le critère d’évaluation principal de cet essai clinique, organisé en collaboration avec Revolution Medicines et Amgen, ouvert chez 46 patients, est le taux de réponse global (ORR).
- Un premier patient a été inclus dans une étude de phase 2 en double aveugle et avec deux bras de traitements, analysant rilzabrutinib, un inhibiteur de BTK, dans le traitement de patients adultes atteints de dermatite atopique modérée à sévère. Le critère d’évaluation principal est la variation en pourcentage de l’indice de surface et de gravité de l’eczéma (EASI). Il est prévu d’inclure 70 patients ne répondant pas ou ne tolérant pas les corticostéroïdes topiques.
- Un premier patient a été inclus dans une étude évaluant SAR441344, un anticorps monoclonal anti-CD40L développé en collaboration avec Immunext, dans le traitement de patients présentant un lupus érythémateux systémique actif.
- Le développement de Sarclisa® chez des patients en attente de transplantation rénale a été arrêté.
- Le développement de SAR445088, un inhibiteur du complément C1s, dans la thrombocytopénie immune (ITP) a été arrêté. Une étude de phase 2 chez des adultes atteints de polyneuropathie inflammatoire démyélinisante chronique (PIDC) et une étude de sécurité et de tolérance chez des adultes atteints de la maladie des agglutinines froides (MAF) se poursuivent.
Phase 1 :
- Une protéine de fusion anti-PD-L1/IL-15, SAR445710 (anciennement KD033), est entrée dans le pipeline de Phase 1 de Sanofi, dans le traitement de tumeurs solides, à la suite de l’acquisition de Kadmon.
- Un premier patient a été inclus dans la première étude clinique de sécurité, de pharmacocinétique, de pharmacodynamie, et d’activité dans diverses hémopathies malignes de SAR443579, un anticorps monoclonal bispécifique anti-NKp46/CD123, développé en collaboration avec Innate Pharma.
- Les premiers participants ont été recrutés dans les études cliniques des nouvelles entités moléculaires développées dans des indications anti-inflammatoires pour : SAR442970, un Nanocorp® VHHs anti-TNF/OX40L, SAR444336, une IL-2 pégylée, SAR443765, un Nanocorps® VHH anti-IL-13/TSLP, et SAR442999, un Nanocorps® VHH anti-TNFa/IL-23A.
- Un premier participant a été inclus dans une étude évaluant SAR443809, un anticorps monoclonal anti-facteur Bb en développement dans le traitement de néphropathies rares.
- Au cours du premier semestre 2022, Sanofi procédera à la restitution à Sangamo de ses droits et obligations relatifs à SAR445136, une thérapie cellulaire par édition de gène (ZFN) développée par Sangamo et Sanofi dans le traitement de la drépanocytose.
- Le développement de SAR439459, un anticorps monoclonal anti-TGFb, dans le traitement de tumeurs solides de stade avancé a été arrêté.
- Le développement de SAR442085, un anticorps monoclonal anti-CD38 Fc modifié, dans le traitement du myélome multiple a été arrêté.
Acquisitions et principales collaborations
- Le 9 novembre, Sanofi a annoncé la finalisation de l’acquisition de Kadmon Holdings, Inc., qui renforce la croissance et l’expansion de son portefeuille de Médecine Générale.
- Le 18 novembre, Sanofi a annoncé un investissement en actions de 180 millions de dollars et une nouvelle collaboration stratégique avec Owkin, entreprise spécialisée dans l’intelligence artificielle et la médecine de précision, dans la volonté d’optimisation de la conception des essais cliniques et de la détection des biomarqueurs prédictifs de maladies, dans des aires thérapeutiques essentielles comme le cancer du poumon, le cancer du sein et le myélome multiple.
- Le 1er décembre, Sanofi a annoncé l’acquisition de Origimm Biotechnology GmbH, une entreprise de biotechnologie spécialisée dans l’étude des composants virulents du microbiote cutané et la découverte d’antigènes bactériens provoquant des maladies dermatologiques.
- Le 21 décembre, Sanofi a annoncé la conclusion d’un accord visant à l’acquisition d’Amunix Pharmaceuticals, Inc., une entreprise spécialisée en immuno-oncologie qui exploite sa plateforme exclusive et cliniquement validée XTEN®, et sa plateforme technologique innovante et universelle de masquage de protéases activables Pro-XTENTM, afin de découvrir et développer des cytokines thérapeutiques et des immunothérapies engageant les lymphocytes T (TCE) afin de transformer les traitements pour les patients atteints d’un cancer. Le pipeline d’Amunix, qui contient notamment le candidat au stade avancé AMX-818, un agent TCE anti-HER2 masqué, représente un véritable atout stratégique pour Sanofi, qui aspire au développement d’immunothérapies anticancéreuses révolutionnaires.
Une présentation actualisée du pipeline de R&D au 31 décembre 2021 est consultable sur notre site Internet :
https://www.sanofi.com/en/science-and-innovation/research-and-development
Avancées dans la mise en œuvre de la stratégie de Responsabilité Sociétale de l’Entreprise (RSE), partie intégrante de notre strategie Play to Win
Sanofi Global Health et Medtronic Labs vont collaborer pour élargir l’accès aux soins de santé dans les pays à revenu faible ou intermédiaire
Dans le monde, les maladies non transmissibles (MNT) sont responsables de 41 millions de décès chaque année, soit l’équivalent de 71% de l’ensemble des décès. Parmi ceux-ci, 37% sont des décès prématurés touchant les personnes âgées de 30 à 69 ans. Les MNT touchent de manière disproportionnée les personnes résidant dans les pays à revenu faible et moyen, où se produisent plus de 75% des décès liés aux MNT et 85% des décès prématurés dans le monde.
Sanofi Global Health lance un partenariat pluriannuel avec Medtronic Labs dans plusieurs pays pour étendre l’accès aux soins de santé pour les patients mal desservis atteints de diabète et d’hypertension. Ce partenariat s’appuiera sur la santé digitale et sur une approche communautaire pour améliorer la sensibilisation aux maladies, les diagnostics et la gestion du diabète et de l’hypertension. La première phase se concentrera sur la Tanzanie et la Sierra Leone où elle vise à ’atteindre plus de 75 000 bénéficiaires, en étroite collaboration avec les partenaires des systèmes de santé. Ce partenariat vise à mettre en place une approche reproductible et durable de la gestion des maladies chroniques axée sur la communauté tout en contribuant au renforcement des systèmes de santé dans la perspective de la couverture sanitaire universelle et des objectifs de développement durable (ODD). Sanofi Global Health s’est associé à Medtronic Labs pour répondre au défi pressant des maladies non transmissibles dans les pays à revenu faible ou intermédiaire.
État d’avancement de notre nouvelle ambition RSE
En 2020, dans le cadre de la définition de nos ambitions RSE renouvelées, nous avons revu et mis à jour notre portefeuille d’initiatives. Les chiffres indiqués pour 2021 ci-dessous servent de base de référence pour montrer nos progrès continus dans la mise en œuvre de la stratégie RSE de Sanofi.
Accès aux soins
Sanofi Global Health, une unité à but non lucratif créée au sein de l’entreprise en avril 2021, a pour objectif de fournir 30 des médicaments essentiels de Sanofi dans un large éventail de domaines thérapeutiques aux patients dans 40 pays parmi les plus pauvres. Au-delà des produits fournis, Sanofi Global Health se concentrera également sur les programmes intégrés qui assurent une gestion optimale des soins pour les patients.
Sanofi s’est également engagé à aider 1 000 patients atteints de maladies rares qui n’ont pas accès aux traitements et fait don de 100 000 flacons de médicaments pour leurs traitements chaque année. Sanofi poursuit ainsi son engagement de 30 ans en faveur des patients souffrant de maladies rares, telles que les maladies de Fabry, Gaucher ou Pompe, pour lesquelles l’accès au traitement est souvent limité.
Notre troisième initiative en matière d’accès consiste à élaborer un plan d’accès mondial pour tous les nouveaux produits, afin de les rendre disponibles sur certains marchés pertinents dans les deux ans suivant leur lancement.
| Tableau de bord accès aux soins |
FY 2021 |
| Sanofi Global Health |
| Malaria |
- 9 276 504 patients traités
- 23 pays
|
| Tuberculose |
- 146 356 patients traités
- 28 pays
|
| Maladies non transmissibles |
- 40 439 patients traités
- 16 pays
|
| Dons de flacons contre les maladies rares |
| # Patients traités |
1 083 |
| #Flacons donnés |
109 677 |
| Plan d’accès Global |
| # de plans d’accès |
Phase pilote en cours |
R&D pour les communautés vulnérables
Sanofi poursuit ses efforts pour combattre la polio et la maladie du sommeil, deux de ses programmes historiques qui s’attaquent à des problèmes de santé mondiaux.
Sanofi a participé à la lutte contre la polio dès le début et continue de jouer un rôle essentiel dans la fourniture de vaccins contre la polio. Sanofi s’est engagée aux côtés de l’OMS à éliminer la maladie du sommeil chez l’homme d’ici 2030.
Enfin, une partie de l’ambition de Sanofi en matière de R&D est de développer des médicaments innovants pour éliminer les décès dus au cancer chez les enfants.
| Tableau de bord R&D pour les communautés vulnérables |
FY 2021 |
| Eradiquer la Polio |
| # Doses VPI délivrées
(VPI Vaccin antipoliomyélitique inactivé) |
50,5 millions de doses VPIs délivrées à UNICEF pour les pays GAVI
|
| Eliminer la maladie du sommeil
(A fin 2020, les données 2021 seront disponibles en Avril 2022) |
| # Patients testés |
1,6 million |
| # Patients traités |
663 |
| Développer des médicaments innovants pour éliminer les cancers de l’enfant |
| # actifs identifiés |
2; études précliniques lancées |
Une planète saine
Pour contribuer à une meilleure conservation des ressources, Sanofi prévoit de supprimer tous les emballages plastiques préformés (blisters) de ses vaccins d’ici 2027. En outre, l’entreprise s’est engagée à éco-concevoir tous ses nouveaux produits d’ici 2025. Pour réduire ses émissions de gaz à effet de serre de 55 % d’ici à 2030, tous les sites de Sanofi utiliseront de l’électricité d’origine 100 % renouvelable et l’entreprise s’est fixée pour objectif de disposer d’une flotte de véhicules neutre en carbone.
| Tableau de bord une planète saine
|
FY 2021 |
| Blister free vaccines |
| % vaccins blisters free produits |
29%
29% |
| Eco-conception |
| # d’analyses de cycle de vie (ACV) |
4 ACVs menées
4 ACVs menées |
| Electricité d’origine renouvelable
(Au troisième trimestre 2021) |
| % électricité d’origine renouvelable sur la consommation électrique totale |
50%
|
| # Sites certifiés RE100 |
57 sites
57 sites |
| Flotte neutre en carbone
(Au troisième trimestre 2021) |
| % flotte neutre sur la flotte totale |
26,2% |
Un lieu de travail inclusif
En tant qu’entreprise mondiale, Sanofi s’engage à ce que ses dirigeants reflètent les communautés et les patients qu’elle sert. L’entreprise s’engage à continuer de favoriser une organisation où tous les employés ont des chances égales d’atteindre des postes à responsabilité au sein de l’entreprise. Notre ambition est d’avoir 40% de femmes dans les postes de direction et 50% de femmes dans les postes de hauts dirigeants d’ici 2025. Sanofi poursuit son engagement social et économique dans les communautés où elle opère. Enfin, Sanofi intègre son engagement sociétal dans le parcours professionnel de ses dirigeants afin de renforcer l’impact social de leurs décisions.
| Tableau de bord Lieu de travail inclusive
|
FY 2021 |
| Une communauté de leader représentative de la société |
| % de femmes |
34.2% de nos executives
40.1% de nos seniors leaders |
| Engagement social et économique
(Dans les pays suivants : France, Etats-Unis, Inde et Suisse) |
| # bénévoles |
2,623 bénévoles |
| # heures de volontariats |
17,461 heures |
| Une expérience sociétale intégrée dans le parcours de nos leaders |
| KPI |
Lancement prévu en 2022 |
Notations ESG
En reconnaissance de la mise en œuvre de la stratégie RSE de Sanofi, plusieurs classements ESG de Sanofi ont été mis à jour de manière positive :
- MSCI: A (précédemment BBB)
- Sustainalytics: 22,9 (précédemment 24,7) à compter du 10/01/2022
- DJSI: 86/100 (précédemment 84/100)
Mise à jour Covid
Sanofi s’est engagée à apporter une solide contribution aux priorités actuelles de santé publique à l’échelle mondiale en contribuant à la production de jusqu’à un demi-milliard de doses de vaccins autorisés. Sanofi est la seule entreprise à mettre ses capacités de fabrication mondiales et son savoir-faire au service de la production de trois vaccins COVID-19 autorisés différents – à savoir ceux développés par BioNTech / Pfizer, Moderna et Johnson & Johnson. Les équipes de fabrication de trois de ses sites industriels, en France, en Allemagne et aux États-Unis, sont en effet à pied d’œuvre et 100 millions de doses ont été produites à fin décembre 2021.
Parallèlement, Sanofi poursuit ses efforts dans la lutte contre la pandémie de COVID-19 avec son candidat vaccin à base de protéines recombinantes adjuvantées, développé en partenariat avec GSK. Les données préliminaires positives du vaccin de rappel ont montré que les anticorps neutralisants ont augmenté pour tous les vaccins primaires reçus (ARNm ou adénovirus) pour tous les groupes d’âge testés, avec un bon profil de sécurité et de tolérance. L’essai de phase 3 continue d’accumuler le nombre d’événements nécessaires à l’analyse, les populations du monde entier étant de plus en plus exposées aux variants du COVID-19 : les résultats sont attendus au premier trimestre 2022. Sanofi a l’intention de déposer des données de rappel auprès des autorités réglementaires à la suite des résultats de la phase 3.
Résultats financiers du quatrième trimestre et de 2021
Résultat net des activités3
Au quatrième trimestre 2021, Sanofi a enregistré un chiffre d’affaires de 9 994 millions d’euros, en hausse de 6,5% (+4,1% à TCC). En 2021, Sanofi a généré un chiffre d’affaires de 37 761 millions d’euros, en progression de 4,8% et de 7,1% à TCC.
Au quatrième trimestre, les autres revenus ont augmenté de 18,9% (+15,5% à TCC) pour s’établir à 421 millions d’euros, incluant la baisse des ventes de produits non-Sanofi distribués par VaxServe (-10,4% à TCC, à 288 millions d’euros). En 2021, les autres revenus ont augmenté de 6,5% (+10,1% à TCC) pour atteindre 1 414 millions d’euros, avec une baisse des ventes de produits non-Sanofi distribués par VaxServe (-2,2% à TCC, à 1 078 millions d’euros).
|

