Santé humaineMolécules
Communiqué de presse
ADOCIA annonce une perte de poids exceptionnelle avec M1Pram chez des personnes obèses atteintes de diabète de type 1 dans une analyse post-hoc
COMMUNIQUE DE PRESSE
Lyon, 6 octobre 2022
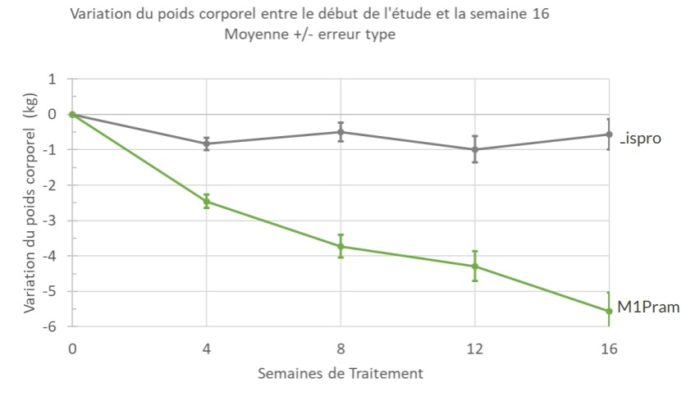
• Une perte de poids de 5,5kg mesurée à 16 semaines de traitement chez des personnes ayant
un diabète de type 1 et un indice de masse corporelle supérieur à 30 kg/m2
• Une efficacité de contrôle glycémique comparable à celle obtenue avec l’insuline
commerciale de référence Humalog® (Eli Lilly)
• Ces résultats ont été présentés lors du 58ème congrès annuel de l’Association Européenne
pour l’Étude du Diabète (EASD) qui s’est tenu à Stockholm du 19 au 23 septembre 2022
7h30 CEST – Adocia (Euronext Paris : FR0011184241 – ADOC), société biopharmaceutique au stade clinique
spécialisée dans la recherche et le développement de solutions thérapeutiques innovantes pour le traitement du
diabète et d’autres maladies métaboliques, annonce des résultats supplémentaires exceptionnels sur son étude
de phase 2 avec M1Pram chez des personnes obèses atteintes de diabète de type 1.
M1PRAM ADRESSE LE BESOIN MEDICAL NON-COUVERT DE L’OBESITE CHEZ DES PERSONNES ATTEINTES DE
DIABETE DE TYPE 1
Des analyses post-hoc ont révélé la plus grande efficacité de M1Pram dans une sous-population de patients obèses
ayant un Indice de Masse Corporelle (IMC) supérieur à 30 kg/m2. La perte de poids était de -5,56 kg dans le groupe
M1Pram contre -0,57 kg dans le groupe Humalog (p=0,03) à 16 semaines de traitement, et la perte de poids
n’avait pas atteint de plateau à la fin de l’étude.
Le questionnaire de satisfaction a clairement démontré un meilleur contrôle de l’appétit avec M1Pram pour 82,4%
des patients (contre 43,2% avec Humalog).
“Étant donné que de plus en plus de personnes atteintes de diabète de type 1 sont en surpoids ou obèses, un produit tel que
M1Pram permet à ces patients de perdre du poids, tout en maintenant un contrôle glycémique, ce qui en fait un résultat
important“, a déclaré Jay S. Skyler, Professeur de Médecine à l’École de Médecine Leonard M. Miller, Université de
Miami.
Pour rappel, l’essai clinique de phase 2 CT041 comparait M1Pram à l’insuline lispro (Humalog, Eli Lilly). Les
résultats positifs sur la population totale de l’étude ont été communiqués le 21 juin 20221. Cette étude incluait des
personnes atteintes de diabète de type 1 et ayant un indice de masse corporelle supérieur à 25kg/m2
(personnes en surpoids et obèses). Le critère principal de l’étude avait été atteint avec une perte de poids significative avec
M1Pram par rapport à Humalog de -2,13kg (p=0,0045) au bout de 4 mois.
TOUT EN ENTRAINANT UNE PERTE DE POIDS, M1PRAM OFFRE UN CONTROLE GLYCEMIQUE EQUIVALENT A
CELUI DE L’INSULINE PRANDIALE DE REFERENCE
M1Pram s’est révélé être équivalent à Humalog pour contrôler la glycémie, aussi sûr en termes de risque
d’hypoglycémie et aussi pratique en termes d’utilisation.
• Les deux traitements permettent de maintenir le taux d’HbA1c et le « temps dans la cible »
thérapeutique (Time-In-Range) chez les patients dont le taux d’HbA1c moyen était de 7,4 % au début
de l’essai
• Le nombre et la sévérité des événements hypoglycémiques sont similaires entre les deux traitements
• Cette coformulation est injectée au moment des repas avec une seule injection
De plus, M1Pram a réduit la dose quotidienne d’insuline prandiale de 21% dans la population générale de l’étude.
M1Pram a présenté globalement un bon profil de sécurité. La différence dans le total des effets indésirables de
M1Pram par rapport à Humalog (76 vs. 38) était principalement due à des effets secondaires gastro-intestinaux
en ligne avec ceux documentés dans la littérature sur le pramlintide.
L’OBESITE, UNE COMORBIDITE MAJEURE CHEZ LES PERSONNES SOUFFRANT DE DIABETE DE TYPE 1 ET UN
BESOIN MEDICAL NON-COUVERT
Neuf millions de personnes souffrent actuellement d’un diabète de type 1 dans le monde et ce chiffre va doubler
sur les prochaines années2. 65%3 d’entre elles sont en situation de surpoids (IMC>25kg/m2) et environ 37%4 en
situation d’obésité (IMC>30kg/m2) notamment du fait de l’effet anabolisant de l’insuline utilisée quotidiennement
afin de réguler le diabète.
De plus, des données récentes semblent indiquer que l’obésité contribue à la résistance à l’insuline, à la
dyslipidémie et aux complications cardiométaboliques associées au diabète de type 15.
À ce jour, le pramlintide est le seul produit ayant un effet sur la perte de poids que la FDA a approuvé comme
adjuvant à l’insuline pour les personnes atteintes de diabète de type 1.
M1PRAM EST EN MESURE DE REMPLACER L’INSULINE PRISE AU MOMENT DES REPAS CHEZ LES PERSONNES
OBESES SOUFFRANT DE DIABETE
M1Pram combine l’insuline M1 et le pramlintide dans un stylo à insuline standard. La coformulation M1Pram est
brevetée par Adocia jusqu’en 2038.
Le pramlintide est un analogue de l’amyline que la FDA a approuvé comme adjuvant à l’insuline dans le diabète de
type 1 et de type 2. Le pramlintide a démontré avoir des effets significatifs dans l’amélioration du contrôle
glycémique, la perte de poids chez des patients en surpoids et le bien-être. Malgré ses avantages cliniques, le
pramlintide est peu utilisé par les patients car il nécessite 3 injections supplémentaires en plus des injections
quotidiennes d’insuline ; ces deux hormones étant normalement incompatibles dans une formulation. Fort de 15
années d’expérience dans la formulation de protéines et plus particulièrement dans le domaine du diabète, Adocia
est parvenu à formuler le pramlintide et l’insuline ensemble, dans un seul et même stylo.
“Lors du congrès annuel de l’EASD, le caractère unique de M1Pram, insuline prandiale qui permet une perte de poids
significative, a suscité l’intérêt de plusieurs sociétés impliquées dans le traitement du diabète. Notre objectif est
maintenant d’établir un partenariat stratégique afin de poursuivre le développement de M1Pram chez les personnes
obèses atteintes de diabète de type 1 mais également d’étendre son application aux personnes obèses atteintes de diabète
de type 2 “, a déclaré Olivier Soula, Directeur Général Adjoint d’Adocia.
1 https://www.adocia.com/fr/cp-adocia-principaux-resultats-m1pram-fr/
2 Type 1 Diabetes Index https://www.t1dindex.org/
3 Conway B, Miller RG, Costacou T, Fried L, Kelsey S, Evans RW, Orchard TJ. Temporal patterns in overweight and obesity in Type 1 diabetes.
Diabet Med. 2010 Apr;27(4):398-404. doi: 10.1111/j.1464-5491.2010.02956.x. PMID: 20536510; PMCID: PMC3129711
4 Amelia S Wallace, Alex R Chang, Jung-Im Shin, Jodie Reider, Justin B Echouffo-Tcheugui, Morgan E Grams, Elizabeth Selvin, Obesity and
Chronic Kidney Disease in US Adults With Type 1 and Type 2 Diabetes Mellitus, The Journal of Clinical Endocrinology & Metabolism, Volume
107, Issue 5, May 2022, Pages 1247–1256, https://doi.org/10.1210/clinem/dgab927
5 Corbin KD, Driscoll KA, Pratley RE, Smith SR, Maahs DM, Mayer-Davis EJ; Advancing Care for Type 1 Diabetes and Obesity Network
(ACT1ON). Obesity in Type 1 Diabetes: Pathophysiology, Clinical Impact, and Mechanisms. Endocr Rev. 2018 Oct 1;39(5):629-663. doi:
10.1210/er.2017-00191. PMID: 30060120.
A propos d’Adocia
Adocia est une société de biotechnologie spécialisée dans la découverte et le développement de solutions
thérapeutiques dans le domaine des maladies métaboliques, principalement le diabète et l’obésité. La société
dispose d’un large portefeuille de candidats-médicaments issus de trois plateformes technologiques
propriétaires :
1) Une technologie, BioChaperone®, pour le développement d’insulines de nouvelle génération et de
combinaisons associant des insulines à d’autres familles d’hormones ; 2) AdOral®, une technologie de délivrance
orale de peptides ; 3) AdoShell®, un biomatériau synthétique immunoprotecteur pour la greffe de cellules avec une
première application aux cellules pancréatiques pour les patients souffrant de diabète dit « instable ».
Adocia détient plus de 25 familles de brevets.
Installée à Lyon, l’entreprise compte environ 105 collaborateurs. Adocia est une société cotée sur le marché
EuronextTM Paris (Euronext : ADOC ; ISIN : FR0011184241).
Avertissement
Le présent communiqué contient des déclarations prospectives relatives à
Adocia et à ses activités. Adocia estime que ces déclarations prospectives
reposent sur des hypothèses raisonnables. Cependant, aucune garantie ne
peut être donnée quant à la réalisation des prévisions exprimées dans ces
déclarations prospectives qui sont soumises à des risques dont ceux décrits
dans le document d’enregistrement universel d’Adocia déposé auprès de
l’Autorité des marchés financiers le 21 avril 2022 et disponible sur le site
Internet d’Adocia (www.adocia.com), et notamment aux incertitudes
inhérentes à la recherche et développement, aux futures données cliniques
et analyses et à l’évolution de la conjoncture économique, des marchés
financiers et des marchés sur lesquels Adocia est présente.
Les déclarations prospectives figurant dans le présent communiqué
sont également soumises à des risques inconnus d’Adocia ou
qu’Adocia ne considère pas comme significatifs à cette date. La
réalisation de tout ou partie de ces risques pourrait conduire à ce que
les résultats réels, conditions financières, performances ou réalisations
d’Adocia diffèrent significativement des résultats, conditions
financières, performances ou réalisations exprimés dans ces
déclarations. Le présent communiqué et les informations qu’il contient
ne constituent ni une offre de vente ou de souscription, ni la
sollicitation d’un ordre d’achat ou de souscription des actions d’Adocia
dans un quelconque pays.

