Santé humaine
Brève
Comment la nicotine agit sur le cerveau des schizophrènes
Plusieurs études rapportent la forte dépendance à la nicotine des patients schizophrènes. Les chercheurs de l’Institut Pasteur, du CNRS, de l’Inserm et de l’ENS sont parvenus à décrypter grâce à un modèle murin, le mode d’action de la nicotine sur les cellules du cortex préfrontal. Ils ont pu visualiser l’effet direct de la nicotine sur le rétablissement de l’activité normale des cellules nerveuses impliquées dans les troubles psychiatriques, comme la schizophrénie. Ces résultats sont parus dans Nature Medicine, le 23 janvier 2017.
Il a été constaté que les patients schizophrènes avaient fréquemment recours au tabagisme comme automédication pour compenser les déficits dus à leur maladie ou pour les soulager des lourds effets secondaires de leur traitement (léthargie, perte de motivation,…). Le cortex préfrontal (région associée à la cognition : la prise de décision et la mémoire de travail) est une des zones altérées chez les patients présentant des troubles psychiatriques comme la schizophrénie, qui peuvent s’accompagner d’un tabagisme intensif. Dans une situation non pathologique, l’activité du cortex préfrontal est modulée par des neurotransmetteurs (l’acétylcholine) via les récepteurs nicotiniques situés à la surface des cellules nerveuses.
Récemment, la mutation génétique CHRNA5, codant pour une sous-unité du récepteur nicotinique, a été identifiée comme étant associée aux troubles cognitifs des schizophrènes et à la dépendance au tabac.
Dans cette étude, les chercheurs de l’unité de Neurobiologie intégrative des systèmes cholinergiques (Institut Pasteur / CNRS), dirigée par Uwe Maskos, en collaboration avec des chercheurs de l’ENS3 et de l’Inserm3, ont introduit le gène humain CHRNA5 chez la souris afin de reproduire les déficits cérébraux caractéristiques de la schizophrénie, à savoir les troubles comportementaux lors des interactions sociales et des tâches sensorimotrices.
Grâce à une technique d’imagerie in vivo et avec une nouvelle méthode d’analyse computationnelle, les chercheurs ont pu constater une activité diminuée des cellules du cortex préfrontal chez les individus portant la mutation CHRNA5. Ils sont parvenus à identifier précisément le type cellulaire dont l’activité était affectée par la mutation génétique. Il s’agit des interneurones (petits neurones qui établissent des connexions entre des réseaux de neurones).
« Les travaux portant sur ce modèle de la maladie montrent également que lorsque nous administrons de la nicotine, celle-ci se fixe sur les récepteurs nicotiniques des interneurones, et influence l’activité des cellules pyramidales du cortex préfrontal qui retrouvent un état d’excitation normal » explique Fani Koukouli, première auteure de l’étude. La baisse d’activité mesurée chez ce modèle est semblable à celle observée chez les patients atteints de désordres psychiatriques, tels que la schizophrénie et l’addiction.
« L’administration répétée de nicotine rétablissant une activité normale du cortex préfrontal laisse présager une possible cible thérapeutique pour le traitement de la schizophrénie » déclare Uwe Maskos, principal auteur de l’étude. La molécule thérapeutique devra alors présenter la même forme que la nicotine sans en avoir les effets nocifs (dépendance, vieillissement cellulaire, accélération de l’activité cardio-vasculaire …).
Ces travaux sont soutenus par les institutions mentionnées ci-dessus, et bénéficient en outre de financements des Laboratoires d’excellence BIO-PSY et IEC, de l’Inca, de la région Ile-de-France (DIM/NeRF). Fani Koukouli a été doctorante au sein du « Pasteur Paris University Doctoral Program (PPU) » et elle a reçu une bourse de la Fondation Stavros Niarchos (Grèce).
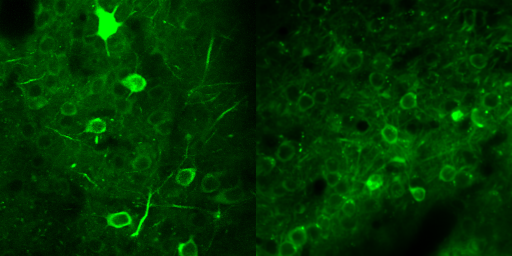
Image : Activité neuronale dans le cortex préfrontal de contrôle (à gauche) et dans un cortex exprimant la mutation humaine CHRNA5 (à droite). © Institut Pasteur (Cliquer sur l’image pour accéder au film)
Source
Nicotine reverses hypofrontality in animal models of addiction and schizophrenia, Nature Medicine, 23 janvier 2017
Fani Koukouli1, 2, Marie Rooy3, Dimitrios Tziotis4, Kurt A. Sailor2, 5, Heidi C. O’Neill6, Josien Levenga6, Mirko Witte7, Michael Nilges4, Jean-Pierre Changeux2, Charles A. Hoeffer6, Jerry A. Stitzel6, Boris S. Gutkin3, 8, David A. DiGregorio2, 9 & Uwe Maskos1, 2*
1 Institut Pasteur, Neurobiologie intégrative des systèmes cholinergiques, Paris, France
2 CNRS UMR 3571, Paris, France
3 Group for Neural Theory, Laboratoire de Neurosciences Cognitives, INSERM Unité 969, Département d’Études Cognitive, École Normale Supérieure, Paris, France
4 Institut Pasteur, Structural Bioinformatics Unit, CNRS UMR 3528, Paris, France
5 Institut Pasteur, Perception and Memory Unit, Paris, France
6 Institute for Behavioral Genetics, University of Colorado, Boulder, CO, USA
7 Institute for Neuroanatomy, Universitätsmedizin Göttingen, Georg-August-Universität, Göttingen, Germany
8 Centre for Cognition and Decision Making, National Research University Higher School of Economics, Moscow, Russia
9 Institut Pasteur, Dynamic Neuronal Imaging Unit, Paris, France
* Auteur correspondant

