Afin d’assurer leur renouvellement, les tissus humains éliminent constamment des cellules par millions sans mettre en péril leur cohésion, leur forme et leur intégrité. Les mécanismes impliqués dans le maintien de cette cohésion restent pour le moment indéterminés. Des chercheurs et chercheuses de l’Institut Pasteur et du CNRS révèlent aujourd’hui un nouveau processus permettant aux cellules éliminées de protéger transitoirement leurs voisines de la mort cellulaire et de maintenir ainsi la cohésion du tissu. Ce mécanisme de protection est essentiel et sa perturbation conduit à des pertes transitoires d’imperméabilité. En effet, les scientifiques ont observé que lorsque ce mécanisme est désactivé, l’élimination simultanée de plusieurs cellules voisines empêche le maintien de la cohésion des tissus. Ces défauts de cohésion pourraient être à l’origine d’inflammation chronique. Les résultats de cette étude ont été publiés dans le journal Developmental Cell, le 2 juin 2021.
Les épithéliums humains sont des tissus présents dans de nombreuses parties du corps (épiderme, muqueuses internes par exemple), composés de couches de cellules jointives jouant le rôle de barrière physique et chimique. Ce rôle est constamment mis à l’épreuve par l’environnement extérieur ainsi que par leur propre renouvellement. Le renouvellement des tissus repose sur la formation de nouvelles cellules par division cellulaire et sur l’élimination des cellules mortes. Les mécanismes régulant la capacité des épithéliums à maintenir leur cohésion dans les contextes impliquant de nombreuses éliminations cellulaires restent encore méconnus. Il s’agit pourtant d’une situation courante que l’on peut observer lors de l’embryogénèse ou lors du maintien de tissus adultes. A titre d’exemple, plus de dix milliards de cellules peuvent être éliminées chaque jour dans l’intestin d’un adulte. Comment sont orchestrées ces éliminations pour maintenir la cohésion du tissu et leur imperméabilité ?
Des chercheurs et chercheuses de l’Institut Pasteur et du CNRS ont voulu identifier les mécanismes participant à la cohésion des épithéliums et les conditions pouvant affecter leur imperméabilité en utilisant la drosophile (ou mouche du vinaigre), un organisme étudié en laboratoire dont l’organisation des épithéliums est très similaire aux humains.
En utilisant des marqueurs fluorescents sensibles à l’activité des protéines, l’équipe de recherche révèle que la mort d’une cellule entraîne l’activation temporaire de la voie EGFR-ERK chez les cellules voisines, une voie d’activation de signaux cellulaires connue pour son implication dans la régulation de la survie des cellules. Les scientifiques ont observé que l’activation de la voie EGFR-ERK permet de protéger pendant une heure environ les cellules voisines de la mort cellulaire et empêche ainsi l’élimination simultanée d’un groupe de cellules. « Nous savions déjà que cette voie est un régulateur central de la survie des cellules dans le tissu, néanmoins nous avons été surpris d’observer de telles dynamiques de protection entre les cellules », commente Romain Levayer, responsable de l’unité Mort cellulaire et homéostasie des épithéliums à l’Institut Pasteur et dernier auteur de cette étude.
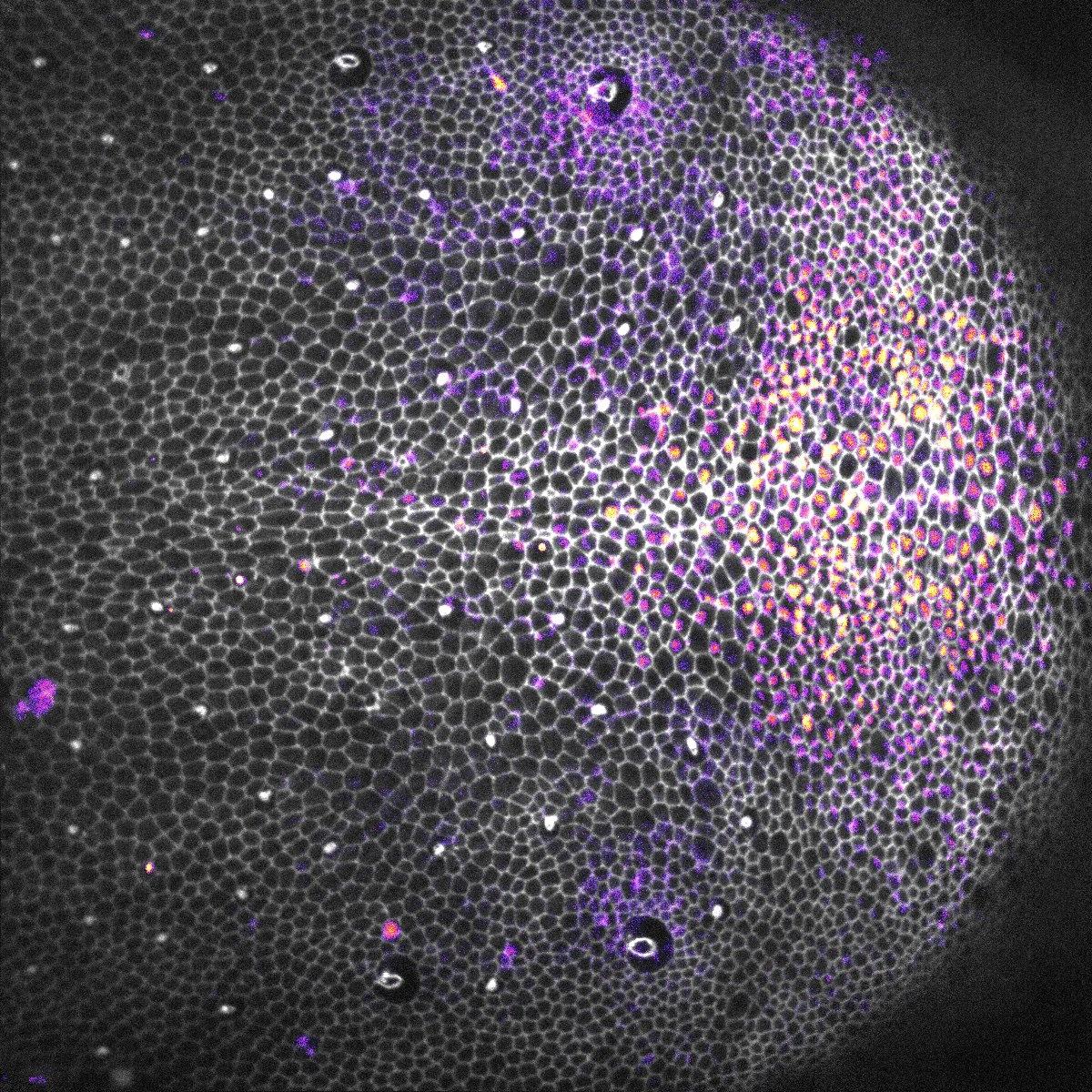
Un épithélium de pupe de Drosophile montrant les contours cellulaires (niveaux de gris) et le rapporteur de la voie EGFR-ERK (gradient jaune-violet).
© Institut Pasteur / Romain Levayer et Léo Valon
Les travaux des scientifiques montrent également que l’inhibition de ce mécanisme de protection a un effet drastique sur le tissu : l’élimination des cellules devient alors aléatoire et des cellules voisines peuvent être éliminées simultanément et engendrer des pertes d’imperméabilité à répétition. Ces éliminations en groupe ne sont jamais observées dans le tissu en situation normale, c’est-à-dire quand il n’y a pas d’inhibition provoquée de la voie EGFR-ERK, même lorsqu’un grand nombre de cellules sont éliminées.
En utilisant un nouvel outil optogénétique permettant de contrôler dans le temps et l’espace la mort des cellules et de court-circuiter le mécanisme de protection, les chercheurs et chercheuses confirment ainsi que la cohésion de l’épithélium se dégrade dès que des cellules voisines sont éliminées simultanément. « De manière surprenante, le tissu est très sensible à la distribution spatiale des cellules éliminées. Alors que le tissu peut résister à un grand nombre d’éliminations, la cohésion de l’épithélium est affectée dès que trois cellules voisines sont éliminées simultanément » précise Léo Valon, chercheur au sein de l’unité Mort cellulaire et homéostasie des épithéliums à l’Institut Pasteur et premier auteur de cette étude.
Ces observations corroborent la nécessité pour les tissus de mettre en place des mécanismes empêchant les éliminations groupées. « Ces observations sont importantes car elles illustrent l’incroyable capacité d’auto-organisation des tissus biologiques, une propriété qui leur permet de résister à de nombreuses conditions de stress. Ainsi, il n’y a pas besoin d’un chef d’orchestre pour déterminer où et quand les cellules meurent, tout est basé sur des communications très locales entre cellules voisines » ajoute Romain Levayer.
Ce processus semble avoir été conservé au cours de l’évolution. Ainsi, le même mécanisme de protection basé sur des activations locales de EGFR-ERK a été découvert de façon indépendante dans des lignées de cellules humaines par le groupe de recherche dirigé par Olivier Pertz à l’université de Berne en Suisse (ces résultats sont publiés dans le même journal2). Les résultats de cette autre étude suggèrent que le mécanisme de protection est conservé entre des espèces qui se sont pourtant séparées il y a plusieurs centaines de millions d’années. Il s’agirait donc d’un mécanisme relativement universel.
Des recherches futures permettront de savoir si la perturbation de ce mécanisme de coordination des morts cellulaires et les pertes répétitives de l’imperméabilité des tissus pourraient être une des causes d’inflammation chronique, ce phénomène provoquant des maladies qui sont aujourd’hui l’une des causes majeures de mortalité dans le monde.
Distribution des morts cellulaires dans un e?pithe?lium de Drosophile :
De?veloppement de l’e?pithe?lium de la pupe de Drosophile montrant la localisation de l’ensemble des morts cellulaires (points colore?s). Le contour des cellules est visible en gris.
© Institut Pasteur / Le?o Valon et Romain Levayer
Activation de la voie EGFR-ERK dans les cellules voisines :
Activation de la voie EGFR-ERK dans les voisines d’une cellule expulse?e du tissu. Le rapporteur a? gauche est exclu du noyau lors de l’activation de la voie (la cellule e?limine?e est entoure?e par un cercle vert). L’activation peut aussi e?tre visualise?e par d’autres senseurs de la voie (senseur FRET, rouge pour une forte activation, bleu pour les faibles niveaux).
© Institut Pasteur / Romain Levayer et Le?o Valon
Source
1. Robustness of epithelial sealing is an emerging property of local ERK feedback driven by cell elimination, Developmental Cell, 2 juin 2021
Léo Valon1, An?ela Davidovi?2, Florence Levillayer1, Alexis Villars1,3, Mathilde Chouly1, Fabiana Cerqueira-Campos1 and Romain Levayer1*
1. Department of Developmental and Stem Cell Biology, Institut Pasteur, CNRS UMR 3738, 25 rue du Dr. Roux, 75015 Paris
2. Department of Computational Biology, Institut Pasteur, CNRS USR 3756, 28 rue du Dr. Roux, 75015 Paris
3. Sorbonne Université, Collège Doctoral, F75005 Paris, France
Doi: 10.1016/j.devcel.2021.05.006
2. Collective ERK/Akt activity waves orchestrate epithelial homeostasis by driving apoptosis-induced survival, Developmental Cell, 2 juin 2021
Paolo Armando Gagliardi1, Maciej Dobrzy?ski1, Marc-Antoine Jacques1, Coralie Dessauges1, Pascal Ender1, Yannick Blum1, Robert M Hughes2, Andrew R. Cohen3, Olivier Pertz1*
1. Institute of Cell Biology, University of Bern, Baltzerstrasse 4, 3012 Bern, Switzerland
2. Department of Chemistry, East Carolina University, Greenville, North Carolina, USA
3. Department of Electrical and Computer Engineering, Drexel University, 3120-40 Market Street, Suite 313, Philadelphia, PA 19104, USA
Doi: 10.1016/j.devcel.2021.05.00
